 Ilustrasi unsur kimia(Pexels)
Ilustrasi unsur kimia(Pexels)
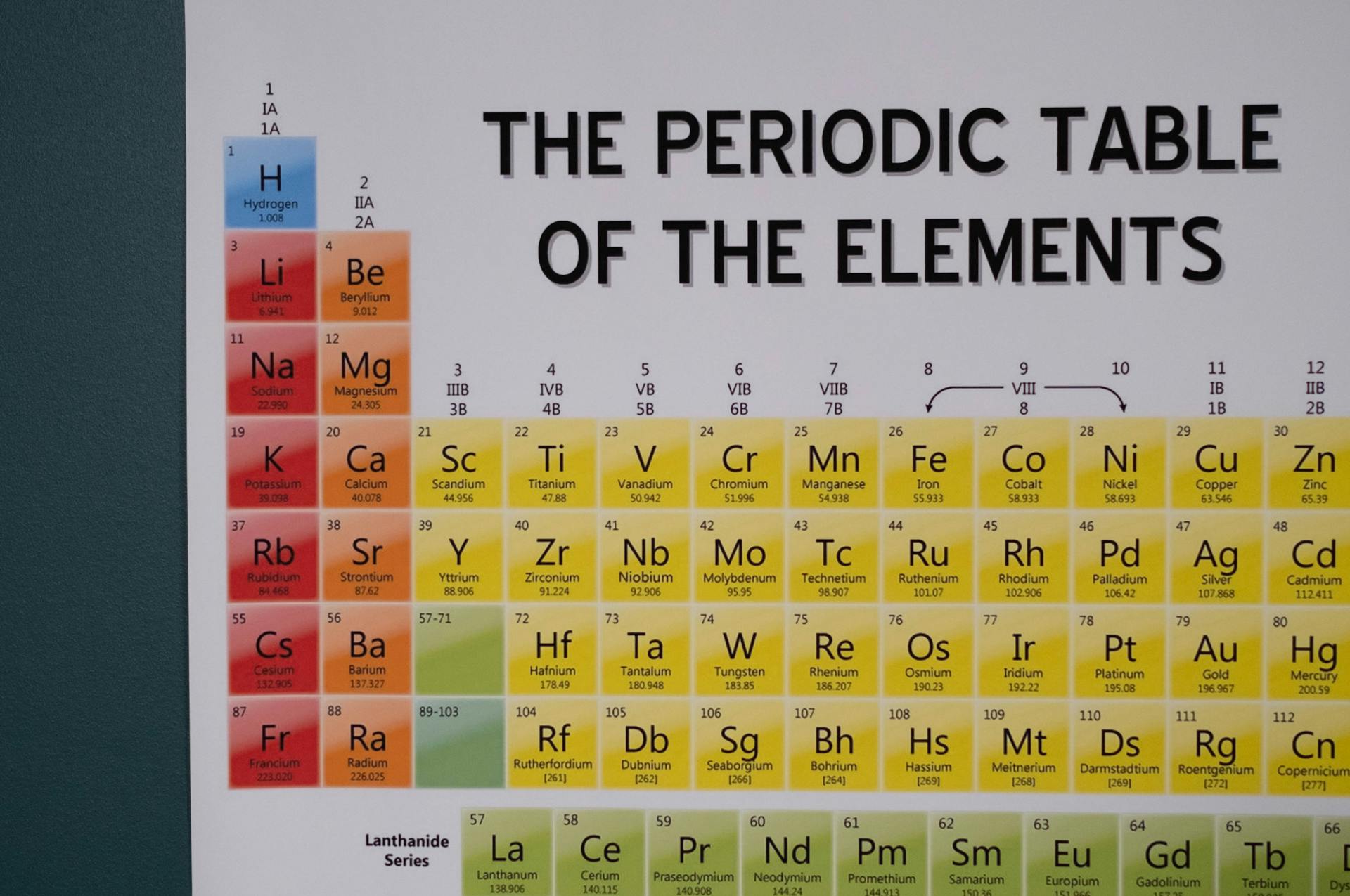
Dunia kimia dibangun di atas fondasi yang kokoh, dan salah satu pilar utamanya adalah Papan Periodik Unsur. Lebih dari sekadar daftar elemen, ia adalah peta komprehensif yang mengungkap sifat-sifat dasar materi dan bagaimana mereka berinteraksi. Memahami Papan Periodik adalah kunci untuk membuka rahasia reaksi kimia, sifat material, dan bahkan asal usul alam semesta.
Sejarah dan Evolusi Papan Periodik
Perjalanan menuju Papan Periodik modern adalah kisah penemuan dan penyempurnaan yang berlangsung selama berabad-abad. Upaya awal untuk mengklasifikasikan unsur-unsur didorong oleh keinginan untuk memahami keteraturan yang mendasari keragaman materi. Salah satu tonggak penting adalah Hukum Triad yang diusulkan oleh Johann Wolfgang Döbereiner pada tahun 1829, yang mengamati bahwa beberapa unsur dapat dikelompokkan menjadi tiga serangkai berdasarkan kemiripan sifat kimia mereka.
Namun, terobosan sesungguhnya datang pada tahun 1869 ketika Dmitri Mendeleev, seorang kimiawan Rusia, menerbitkan Papan Periodik pertamanya. Mendeleev menyusun unsur-unsur berdasarkan massa atom mereka dan mengamati bahwa sifat-sifat unsur berulang secara periodik. Yang lebih luar biasa lagi, Mendeleev meninggalkan celah dalam tabelnya untuk unsur-unsur yang belum ditemukan, dan ia bahkan memprediksi sifat-sifat unsur-unsur tersebut dengan akurasi yang mencengangkan. Prediksi Mendeleev terbukti benar ketika unsur-unsur seperti galium, skandium, dan germanium ditemukan dalam beberapa tahun berikutnya, mengukuhkan Papan Periodiknya sebagai alat yang ampuh untuk memahami dan memprediksi perilaku kimia.
Papan Periodik Mendeleev tidak sempurna. Ada beberapa anomali dalam urutan massa atom, dan penemuan gas mulia pada akhir abad ke-19 menimbulkan tantangan baru. Namun, masalah-masalah ini akhirnya diselesaikan dengan pengembangan teori atom modern dan pemahaman tentang struktur atom. Pada tahun 1913, Henry Moseley, seorang fisikawan Inggris, menemukan bahwa sifat-sifat unsur lebih akurat berkorelasi dengan nomor atom mereka, yaitu jumlah proton dalam inti atom. Penemuan Moseley mengarah pada Papan Periodik modern, yang disusun berdasarkan nomor atom dan mencerminkan struktur elektronik unsur-unsur.
Organisasi dan Tren dalam Papan Periodik
Papan Periodik modern adalah tabel yang sangat terstruktur yang mengatur unsur-unsur berdasarkan nomor atom dan konfigurasi elektron mereka. Tabel ini terdiri dari baris horizontal yang disebut periode dan kolom vertikal yang disebut golongan (atau keluarga). Unsur-unsur dalam golongan yang sama memiliki sifat kimia yang serupa karena mereka memiliki jumlah elektron valensi yang sama, yaitu elektron di kulit terluar atom.
Ada beberapa tren penting yang dapat diamati dalam Papan Periodik. Salah satunya adalah tren elektronegativitas, yaitu ukuran kemampuan atom untuk menarik elektron dalam ikatan kimia. Elektronegativitas cenderung meningkat dari kiri ke kanan dalam suatu periode dan menurun dari atas ke bawah dalam suatu golongan. Tren lain adalah tren energi ionisasi, yaitu energi yang dibutuhkan untuk menghilangkan elektron dari atom. Energi ionisasi cenderung meningkat dari kiri ke kanan dalam suatu periode dan menurun dari atas ke bawah dalam suatu golongan.
Ukuran atom juga menunjukkan tren periodik. Ukuran atom cenderung menurun dari kiri ke kanan dalam suatu periode karena peningkatan muatan inti efektif menarik elektron lebih dekat ke inti. Ukuran atom cenderung meningkat dari atas ke bawah dalam suatu golongan karena penambahan kulit elektron baru.
Sifat logam juga bervariasi secara periodik. Logam cenderung berada di sisi kiri Papan Periodik, sedangkan nonlogam cenderung berada di sisi kanan. Metaloid, yang memiliki sifat antara logam dan nonlogam, terletak di sepanjang garis diagonal yang memisahkan logam dan nonlogam.
Golongan Unsur dan Sifat-sifatnya
Papan Periodik dapat dibagi menjadi beberapa golongan unsur, masing-masing dengan sifat-sifat yang khas. Beberapa golongan yang paling penting meliputi:
- Logam Alkali (Golongan 1): Logam alkali adalah logam yang sangat reaktif yang mudah kehilangan satu elektron untuk membentuk ion dengan muatan +1. Mereka adalah konduktor panas dan listrik yang baik dan memiliki titik leleh dan titik didih yang rendah. Contoh logam alkali termasuk litium, natrium, dan kalium.
- Logam Alkali Tanah (Golongan 2): Logam alkali tanah juga reaktif, tetapi tidak sereaktif logam alkali. Mereka kehilangan dua elektron untuk membentuk ion dengan muatan +2. Mereka juga merupakan konduktor panas dan listrik yang baik, tetapi memiliki titik leleh dan titik didih yang lebih tinggi daripada logam alkali. Contoh logam alkali tanah termasuk berilium, magnesium, dan kalsium.
- Logam Transisi (Golongan 3-12): Logam transisi adalah golongan unsur yang besar dan beragam yang memiliki berbagai macam sifat. Mereka umumnya keras, kuat, dan memiliki titik leleh dan titik didih yang tinggi. Banyak logam transisi adalah katalis yang baik, yang berarti mereka dapat mempercepat reaksi kimia tanpa dikonsumsi dalam reaksi tersebut. Contoh logam transisi termasuk besi, tembaga, dan emas.
- Halogen (Golongan 17): Halogen adalah nonlogam yang sangat reaktif yang mudah mendapatkan satu elektron untuk membentuk ion dengan muatan -1. Mereka adalah oksidator yang kuat dan digunakan dalam berbagai aplikasi, termasuk disinfektan, pemutih, dan refrigeran. Contoh halogen termasuk fluor, klor, dan brom.
- Gas Mulia (Golongan 18): Gas mulia adalah gas yang sangat tidak reaktif yang memiliki kulit elektron valensi yang penuh. Mereka digunakan dalam berbagai aplikasi, termasuk lampu, las, dan pendinginan. Contoh gas mulia termasuk helium, neon, dan argon.
Blok Unsur dan Konfigurasi Elektron
Selain pengelompokan berdasarkan golongan, Papan Periodik juga dapat dibagi menjadi blok-blok berdasarkan orbital atom terakhir yang terisi elektron. Blok-blok ini adalah blok-s, blok-p, blok-d, dan blok-f.
- Blok-s: Blok-s terdiri dari golongan 1 dan 2, serta helium. Unsur-unsur dalam blok-s memiliki elektron valensi dalam orbital-s.
- Blok-p: Blok-p terdiri dari golongan 13 hingga 18, kecuali helium. Unsur-unsur dalam blok-p memiliki elektron valensi dalam orbital-p.
- Blok-d: Blok-d terdiri dari golongan 3 hingga 12. Unsur-unsur dalam blok-d memiliki elektron valensi dalam orbital-d.
- Blok-f: Blok-f terdiri dari lantanida dan aktinida, yang terletak di bagian bawah Papan Periodik. Unsur-unsur dalam blok-f memiliki elektron valensi dalam orbital-f.
Konfigurasi elektron suatu unsur menentukan sifat-sifat kimianya. Unsur-unsur dengan konfigurasi elektron valensi yang sama memiliki sifat kimia yang serupa. Misalnya, semua logam alkali memiliki konfigurasi elektron valensi ns1, yang berarti mereka mudah kehilangan satu elektron untuk membentuk ion dengan muatan +1.
Isotop dan Massa Atom
Semua atom dari suatu unsur memiliki jumlah proton yang sama, tetapi mereka dapat memiliki jumlah neutron yang berbeda. Atom-atom dari unsur yang sama yang memiliki jumlah neutron yang berbeda disebut isotop. Isotop memiliki sifat kimia yang sama, tetapi mereka memiliki massa atom yang berbeda.
Massa atom suatu unsur adalah rata-rata tertimbang dari massa isotop-isotopnya. Massa atom yang tercantum dalam Papan Periodik adalah massa atom relatif, yang merupakan massa atom yang dibandingkan dengan massa atom karbon-12. Massa atom relatif tidak memiliki satuan.
Isotop digunakan dalam berbagai aplikasi, termasuk penanggalan radiokarbon, pelacakan, dan pengobatan medis. Misalnya, karbon-14, isotop radioaktif karbon, digunakan untuk menentukan usia benda-benda organik. Isotop juga digunakan sebagai pelacak untuk mempelajari proses biologis dan kimia. Dalam pengobatan medis, isotop digunakan dalam pencitraan diagnostik dan terapi radiasi.
Senyawa dan Ikatan Kimia
Unsur-unsur dapat bergabung untuk membentuk senyawa melalui ikatan kimia. Ikatan kimia adalah gaya tarik-menarik antara atom yang menyatukan mereka dalam molekul atau senyawa ionik. Ada tiga jenis utama ikatan kimia: ikatan ionik, ikatan kovalen, dan ikatan logam.
- Ikatan Ionik: Ikatan ionik terbentuk ketika elektron ditransfer dari satu atom ke atom lain. Atom yang kehilangan elektron menjadi ion positif (kation), dan atom yang mendapatkan elektron menjadi ion negatif (anion). Gaya tarik-menarik elektrostatik antara ion-ion yang berlawanan muatan membentuk ikatan ionik. Ikatan ionik biasanya terbentuk antara logam dan nonlogam. Contoh senyawa ionik adalah natrium klorida (NaCl), atau garam dapur.
- Ikatan Kovalen: Ikatan kovalen terbentuk ketika atom berbagi elektron. Ikatan kovalen biasanya terbentuk antara nonlogam. Contoh senyawa kovalen adalah air (H2O) dan metana (CH4).
- Ikatan Logam: Ikatan logam terbentuk antara atom-atom logam. Dalam ikatan logam, elektron valensi dilepaskan dari atom-atom logam dan membentuk lautan elektron yang dapat bergerak bebas di seluruh struktur logam. Lautan elektron ini bertanggung jawab atas sifat-sifat logam yang baik sebagai konduktor panas dan listrik.
Sifat-sifat senyawa tergantung pada jenis ikatan kimia yang menyatukan atom-atomnya. Senyawa ionik biasanya memiliki titik leleh dan titik didih yang tinggi, larut dalam air, dan menghantarkan listrik ketika dilarutkan dalam air. Senyawa kovalen biasanya memiliki titik leleh dan titik didih yang rendah, tidak larut dalam air, dan tidak menghantarkan listrik. Logam memiliki titik leleh dan titik didih yang tinggi, keras, kuat, dan menghantarkan panas dan listrik dengan baik.
Reaksi Kimia dan Stoikiometri
Reaksi kimia adalah proses yang melibatkan penataan ulang atom dan molekul. Reaksi kimia dapat direpresentasikan dengan persamaan kimia, yang menunjukkan reaktan (zat awal) dan produk (zat yang dihasilkan) dari reaksi tersebut.
Stoikiometri adalah studi tentang hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia. Stoikiometri memungkinkan kita untuk menghitung jumlah reaktan yang dibutuhkan untuk menghasilkan sejumlah produk tertentu, atau jumlah produk yang akan dihasilkan dari sejumlah reaktan tertentu.
Persamaan kimia harus seimbang, yang berarti bahwa jumlah atom setiap unsur harus sama di kedua sisi persamaan. Persamaan kimia yang seimbang mematuhi hukum kekekalan massa, yang menyatakan bahwa massa tidak dapat diciptakan atau dimusnahkan dalam reaksi kimia.
Untuk menyeimbangkan persamaan kimia, kita menggunakan koefisien, yang merupakan angka yang ditempatkan di depan rumus kimia dalam persamaan. Koefisien menunjukkan jumlah relatif molekul atau satuan rumus yang terlibat dalam reaksi tersebut.
Misalnya, persamaan kimia untuk pembakaran metana (CH4) adalah:
CH4 + 2O2 → CO2 + 2H2O
Persamaan ini seimbang karena ada satu atom karbon, empat atom hidrogen, dan empat atom oksigen di kedua sisi persamaan.
Aplikasi Papan Periodik dalam Kehidupan Sehari-hari
Papan Periodik bukan hanya alat untuk kimiawan dan ilmuwan. Ia memiliki aplikasi yang luas dalam kehidupan sehari-hari. Berikut adalah beberapa contoh:
- Kedokteran: Unsur-unsur seperti kalsium, kalium, dan natrium sangat penting untuk fungsi tubuh. Obat-obatan dan perawatan medis sering kali melibatkan unsur-unsur dan senyawa-senyawa yang ditemukan dalam Papan Periodik.
- Teknologi: Unsur-unsur seperti silikon, germanium, dan galium digunakan dalam pembuatan perangkat elektronik seperti komputer, ponsel, dan panel surya.
- Pertanian: Unsur-unsur seperti nitrogen, fosfor, dan kalium adalah nutrisi penting bagi tanaman. Pupuk mengandung senyawa-senyawa yang mengandung unsur-unsur ini untuk meningkatkan pertumbuhan tanaman.
- Energi: Unsur-unsur seperti uranium dan plutonium digunakan dalam pembangkit listrik tenaga nuklir. Baterai menggunakan berbagai unsur dan senyawa untuk menyimpan dan melepaskan energi.
- Material: Unsur-unsur dan senyawa-senyawa yang ditemukan dalam Papan Periodik digunakan untuk membuat berbagai macam material, seperti plastik, logam, keramik, dan komposit.
Kesimpulan
Papan Periodik adalah alat yang sangat penting untuk memahami kimia dan dunia di sekitar kita. Ia menyediakan kerangka kerja untuk mengklasifikasikan dan memahami sifat-sifat unsur-unsur, dan ia memiliki aplikasi yang luas dalam berbagai bidang, mulai dari kedokteran hingga teknologi hingga pertanian. Dengan memahami Papan Periodik, kita dapat membuka rahasia materi dan mengembangkan teknologi baru yang dapat meningkatkan kehidupan kita.
Memahami Papan Periodik adalah investasi dalam pemahaman yang lebih dalam tentang dunia. Ia adalah kunci untuk membuka potensi penemuan dan inovasi di masa depan. Teruslah belajar, teruslah bertanya, dan teruslah menjelajahi keajaiban kimia!